mTORC1信号通路整合细胞营养状况、能量水平等信息动态调节细胞生长和代谢。蛋白质翻译起始阶段高度耗能,因此涉及到一系列复杂精细的调控,而mTORC1信号通路是其中的关键调节者。目前已知mTORC1复合体通过磷酸化修饰并调控(4E-BP)家族成员、S6K1等一系列下游底物的活性,正向促进翻译起始过程,但是该过程的具体细节尚未被完全阐明。
真核起始因子 4F (eIF4F) 介导的翻译起始在肿瘤细胞恶性转化过程中起关键作用,其活性增加可促进参与细胞增殖、存活以及肿瘤免疫逃逸的 mRNA翻译起始。eIF4F复合物中,eIF4A1负责解开 mRNA 5'-UTR 区域的复杂二级结构,使得核糖体亚基得以结合并促进帽依赖性翻译。目前开发的eIF4A 小分子抑制剂已在多项体外、体内研究中表现出良好的抗肿瘤活性。但是肿瘤细胞对eIF4A 小分子抑制剂产生耐药的现象已被报道。
IBTK是一个Cullin 3家族的E3泛素连接酶复合体的底物识别亚基。IBTK在多种肿瘤中上调表达,并且在多种肿瘤细胞模型中表现出促增殖、抑凋亡的作用。杂合敲除IBTK可抑制Eμ-myc转基因小鼠的淋巴瘤生成,提示其可能是一个重要的癌基因。但是目前对于IBTK发挥生物学功能的分子机制还知之甚少。
2024年5月10日,复旦大学生命科学学院王陈继团队、上海市第一妇婴保健院/同济大学附属妇产科医院高昆团队合作在eLife在线发表了题为 mTORC1/S6K1 signaling promotes sustained oncogenic translation through modulating CRL3IBTK-mediated ubiquitination of eIF4A1 in cancer cells的研究论文。该研究揭示了mTORC1/S6K1-IBTK-eIF4A1信号轴通过促进帽依赖性翻译和癌蛋白表达的致癌分子途径。

鉴于IBTK的生物学功能不清,研究人员开展了以下研究。首先通过蛋白复合体分离方法(AP-MS和BioID2)鉴定新的IBTK互作蛋白,进而确定CRL3IBTK的靶向底物。通过该方法发现并确证了eIF4A1是IBTK的互作蛋白。IBTK与eIF4A1相互作用并对eIF4A1进行多位点的单泛素化修饰(multiple mono-ubiquitination),此修饰不影响eIF4A1的蛋白稳定性,但是促进eIF4F复合物活性,进而达到调控下游靶基因表达的效果。在多种宫颈癌细胞中敲除IBTK,导致MYC,CDK4,STAT1和CCND3等癌基因的蛋白表达水平下调,而对应 mRNA 水平基本不受 IBTK的影响,这提示IBTK 发挥转录后调控作用。一系列的细胞生物学实验和小鼠荷瘤模型结果表明,IBTK正向调控癌细胞的增殖、迁移/侵袭、锚定非依赖性生长、体内瘤体生长和肿瘤免疫逃逸等恶性转化表型,进一步明确了IBTK扮演癌基因角色。临床样本的免疫组化结果也支持IBTK过表达与宫颈癌的分级、不良预后正相关。此外,敲除IBTK使的肿瘤细胞对 eIF4A1 抑制剂诱导的细胞凋亡更加敏感,这提示了 IBTK 是克服 eIF4A 抑制剂耐药的潜在干预靶点。
后续的实验证实IBTK是mTORC1的直接磷酸化修饰底物。此外,mTORC1下游的 S6K1 激酶也可以磷酸化修饰 IBTK。在营养丰富的条件下,mTORC1和S6K1介导IBTK的双重磷酸化修饰,激活CRL3IBTK复合体介导的 eIF4A1 非降解型泛素化修饰,促进帽依赖性翻译起始。而在营养缺乏条件下,mTORC1/S6K1活性受到抑制,其对IBTK 的磷酸化修饰水平降低,低磷酸化水平的IBTK对 eIF4A1 的泛素化修饰显著减弱,从而最终抑制相关mRNA的帽依赖性翻译起始。癌细胞中存在mTORC1 过度激活或 IBTK 过表达的情况,CRL3IBTK复合体 对 eIF4A1泛素化修饰和帽依赖性翻译起始作用增加,进一步促进肿瘤发生发展进程(图一)。
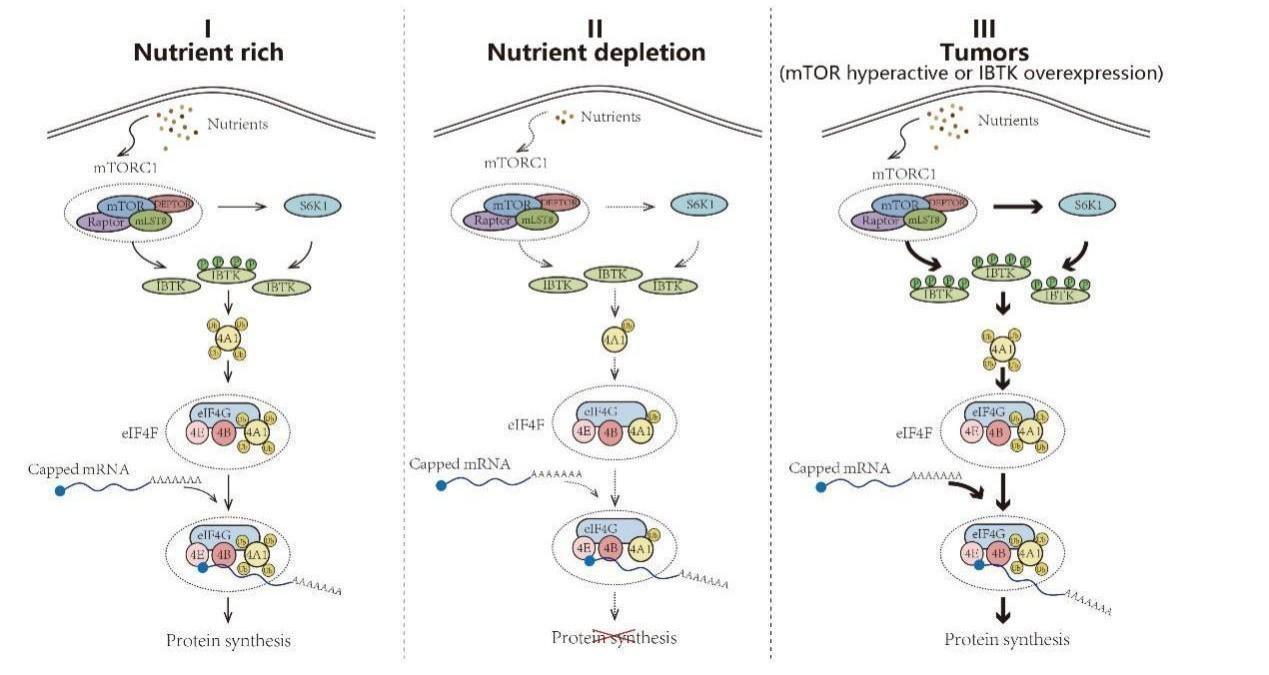
图一、mTORC1/S6K1-IBTK-eIF4A1 信号通路调控的分子机制
这项工作首次提出了 “mTORC1/S6K1-IBTK-eIF4A1” 信号轴失调在肿瘤发生发展过程中的重要作用,加深了对癌细胞如何劫持翻译机器以促进其生存的理解,并为开发新的癌症治疗方法提供了潜在途径。
复旦大学生命科学学院博士生焦冬月,硕士生孙蕙茹(现人类表型组研究院博士生在读)为该论文第一作者。王陈继、高昆为该论文的通讯作者。
原文链接:https://elifesciences.org/reviewed-preprints/92236#metrics

