2020年11月16日,复旦大学生命科学学院董爱武团队与麻锦彪团队合作于 《美国科学院院刊》 (PNAS),在线发表了题为 “NAP1-Related Protein 1 (NRP1) has multiple interaction modes for chaperoning histones H2A-H2B” 的研究论文,揭示了组蛋白分子伴侣NRP1以多种方式识别组蛋白H2A-H2B的分子机制。
Nucleosome assembly protein 1 (NAP1)作为组蛋白H2A-H2B重要的分子伴侣,最早在非洲爪蟾的受精卵中被分离且具有核小体组装活性;随后在酵母、动物和植物中都发现了NAP1的同源蛋白,而且NAP1家族蛋白在进化过程中具有很强的保守性。NAP1-Related Protein 1(NRP1)是拟南芥NAP1家族成员,作为组蛋白H2A-H2B的分子伴侣参与核小体移除,并能与转录因子WER结合激活下游靶基因GL2,调控植物根毛发育。
为了探索NRP1移除核小体的分子机制,董爱武团队和麻锦彪团队合作解析了NRP1与组蛋白H2A-H2B的复合物晶体结构(3.0 Å),发现NRP1的N端结构域可以直接结合H2A-H2B,这是NAP1家族蛋白没有被发现过的一种新的组蛋白结合方式。遗传互补实验表明:NRP1 N端识别H2A-H2B的关键氨基酸突变的蛋白质NRP1-mN不能回复NRP缺失突变体nrp1-1 nrp2-1的表型,证明NRP1 N端结构域与H2A-H2B的相互作用在体内具有重要的生理功能。该工作还解析了NRP1 C端酸性结构域和H2A-H2B的复合物晶体结构(1.65 Å),发现NRP1 C端的[D/E]-X/XX-D-[F/Y]基序在很多H2A-H2B结合蛋白中都存在并以保守的模式结合组蛋白,暗示[D/E]-X/XX-D-[F/Y]基序可以作为H2A-H2B结合蛋白的一个标志。此外,通过体外交联-质谱分析和ITC实验,进一步鉴定了NRP1 Earmuff结构域中参与H2A-H2B结合的关键氨基酸。最后,体外核小体组装与去组装实验证明:NRP1的N端结构域、Earmuff 结构以及C端酸性区域对NRP1发挥功能都是必须的。综上所述,该工作揭示了拟南芥NRP1识别组蛋白H2A-H2B的多种方式,阐明了NRP1介导核小体组装与去组装的结构基础。
2017年,董爱武团队与麻锦彪团队合作在 《植物细胞》 (The Plant Cell)发表了组蛋白分子伴侣NRP1与转录因子WER相互作用调控根毛发育的分子机制;2020年,董爱武团队与甘建华团队合作在 《核酸研究》 (Nucleic Acids Research)发表了WER识别DNA的分子基础;结合刚发表的NRP1识别组蛋白H2A-H2B的结构基础,较为完善地解析了组蛋白分子伴侣NRP1与转录因子相互作用,调控基因表达及植物发育的分子机制。
董爱武团队的博士研究生罗强(董爱武和麻锦彪联合培养)和硕士研究生王百慧为文章的共同第一作者,董爱武教授与麻锦彪教授为共同通讯作者,晶体结构分析得到了甘建华教授的帮助,该研究工作由自然科学基金委和复旦大学遗传工程国家重点实验室资助。
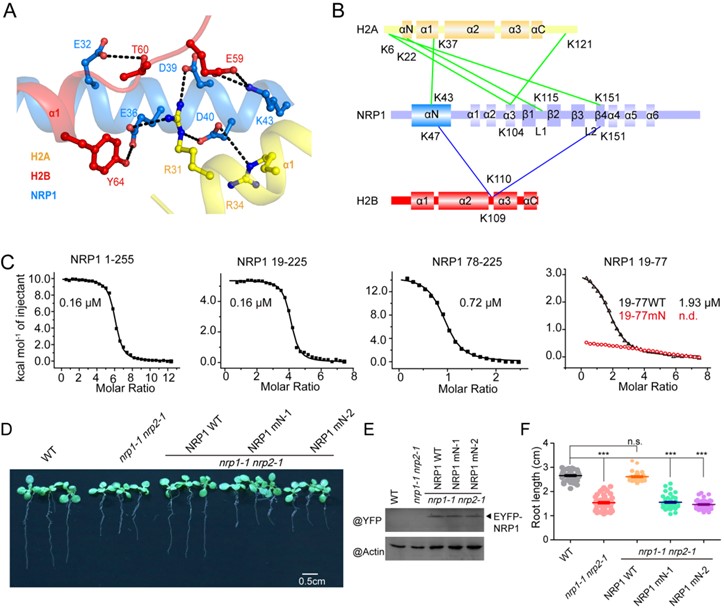
A. NRP1 N端识别H2A-H2B的关键氨基酸;B-C. 交联-质谱和ITC实验显示NRP1的N端和Earmuff 结构域均可结合H2A-H2B;
D-F.遗传互补实验证明NRP1 N端结构域与H2A-H2B的相互作用在体内具有重要的生理功能。
全文链接:https://www.pnas.org/content/early/2020/11/11/2011089117

