2024年7月,复旦大学李继喜教授团队在《Cell Death & Disease》杂志发表了题为“ZBP1 condensate formation synergizes Z-NAs recognition and signal transduction”的研究论文。该研究通过体外和细胞实验证明,ZBP1的Zαβ结构域能结合不同长度的d(CG)n配体;HSV或IAV病毒感染后Zαβ能够形成具有液液相分离的凝聚体。ZBP1的RHIM结构域形成典型淀粉样凝聚体,其核心基序206IQIG209突变会抑制淀粉样纤维的形成,并阻碍细胞程序性坏死发生和抗病毒免疫的应答信号。本研究发现ZBP1不同结构域可形成凝聚体或淀粉样结构,并通过二者之间的协同作用实现Z型核酸(Z-NAs)的识别和下游信号转导,在应对病毒感染的免疫应答过程中发挥关键作用。

Z-DNA结合蛋白1(ZBP1或DAI)是第一个被发现存在于细胞质中的DNA感知蛋白受体。作为固有免疫应答过程中的关键基因,ZBP1通过Zαβ结构域感知Z型核酸刺激,依赖RHIM结构域与RIPK1、RIPK3、TRIF等蛋白结合,参与泛死亡小体(PANoptosome)组装,诱导细胞程序性死亡来抵抗病原体侵染。研究也表明ZBP1与热射病、自身免疫疾病、肠炎、癌症等多种疾病密切相关。
本研究表明ZBP1能够通过Zαβ结构域响应体内异常Z-NAs刺激后,形成一个液滴状凝聚体平台,使ZBP1易于通过RHIM结构域进行自身聚集并与下游蛋白(如RIPK1、RIPK3)结合,揭示了ZBP1在应对病原体感染的免疫反应中的具体调控机制。李继喜课题组长期从事细胞死亡与免疫应答研究。已发现坏死小体组分RIP1/RIP3形成功能性淀粉样纤维复合物,作为级联放大平台,激活程序性细胞坏死(2012,Cell);通过结构生物学方法解析了坏死小体的高分辨率三维结构(2018,Cell);发现多个程序性细胞死亡的调控分子(TRIM21、TRIM25、SP1),并阐明相关作用机理(2021&2022,Cell Death Differ;2023 Mol Neurodegener; 2024 Cell Death Dis)。
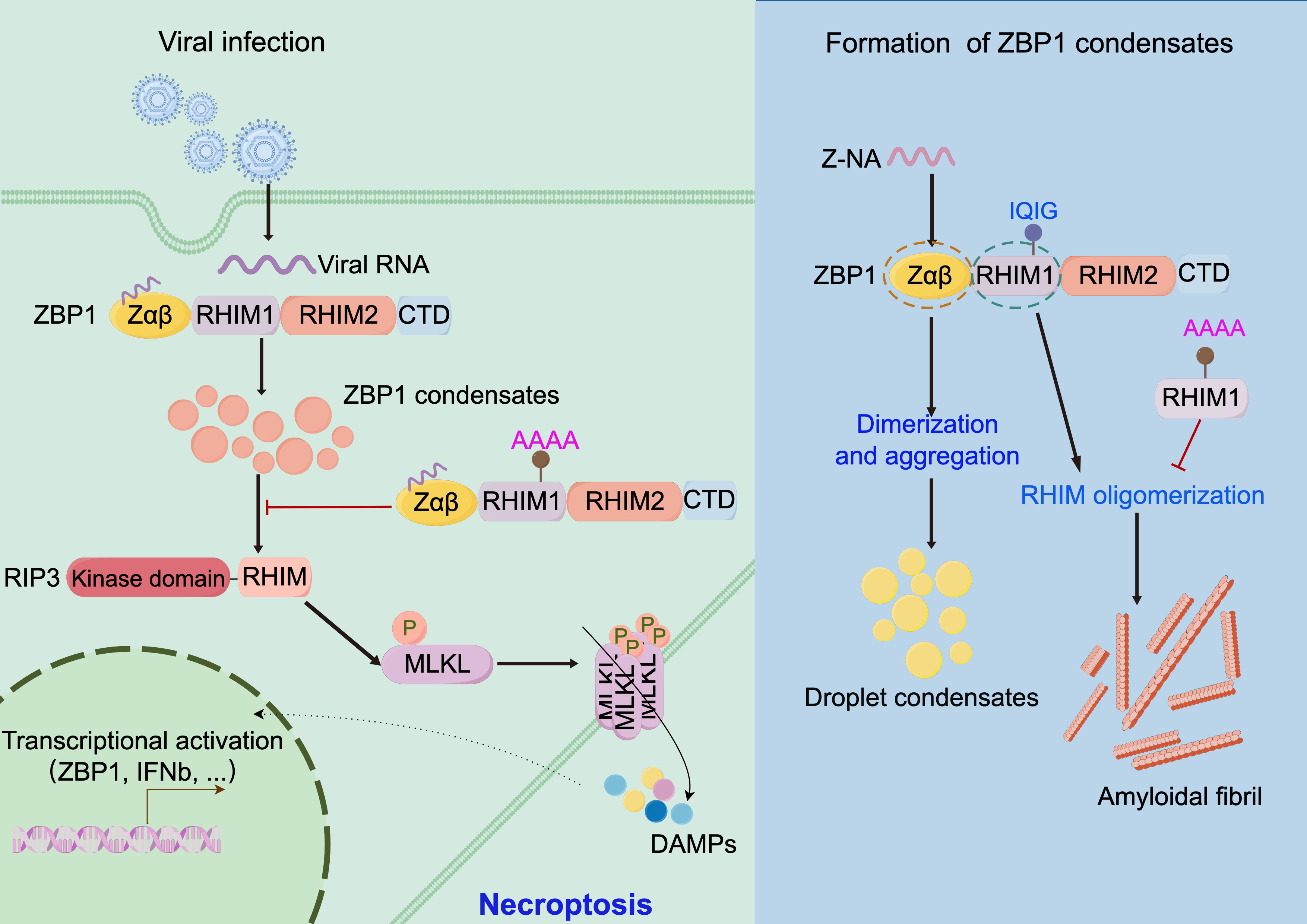
图1. ZBP1通过形成凝聚体来介导Z-NAs识别和下游信号转导
复旦大学生命科学学院谢飞艳博士和吴敌博士为论文共同一作,李继喜教授和温州医科大学苏志鹏教授为论文共同通讯作者。香港科技大学黄晋卿教授给予了支持和帮助。研究工作得到了国家自然科学基金委和科技部国家重点研发计划项目的支持。
论文链接:https://www.nature.com/articles/s41419-024-06889-y

