非洲猪瘟病毒(ASFV)是唯一的Asfarviridae家族病毒。ASFV具有很强的传染性,能导致受感染猪的高度死亡,对全球的猪饲养业都是一种巨大的威胁。我国是生猪养殖和猪肉生产第一大国,ASFV被我国农业部门列为A类传染病,其防控一直是我国农业部门的工作重点之一。然而,ASFV还是于2018年入侵了我国,导致了巨大的经济损失。ASFV是最复杂的DNA病毒之一,其基因组编码了150多种蛋白,涉及了ASFV生命循环的多个过程。甘建华课题组前期报道了ASFV 来源的DNA聚合酶AsfvPolX(Plos Biology, 2017)、DNA连接酶AsfvLIG(Nature Communications, 2019)以及核酸内切酶AsfvAP(Cell Discovery, 2021)的结构,阐明了ASFV DNA修复通路工作的具体机制。但参与ASFV的DNA复制、基因表达、病毒颗粒组装、宿主细胞侵染以及宿主防御逃逸等通路蛋白质的结构报道的还非常少,这些结构的缺乏阻碍了我们对ASFV生命循环的全面理解,也在很大程度上妨碍了ASFV诊断和治疗药物的研发。
2023年8月17日,复旦大学甘建华课题组在Nucleic Acids Research上发表了题为“Structures and implications of the C962R protein of African swine fever virus”的文章,报道了非洲猪瘟病毒来源的C962R蛋白与DNA复合物的结构,阐明了C962R催化DNA解旋以及DNA引物合成的分子机制。

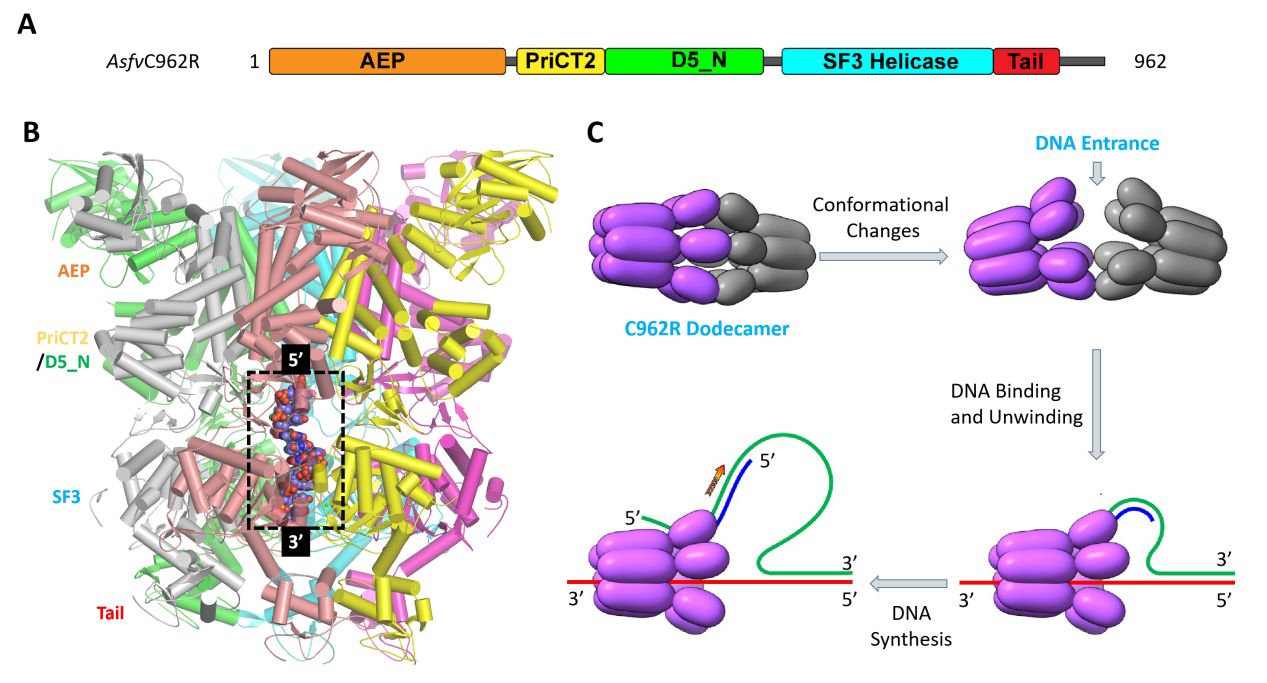
C962R是ASFV DNA复制通路中的关键蛋白之一,在ASFV病毒株中高度保守。尽管C962R的敲除不能完全阻断ASFV的复制,却可以有效延缓受感染猪的临床症状的发生。论文研究显示C962R为多结构域蛋白,其N端的AEP结构域负责新生DNA的从头合成及延伸,而其SF3 Helicase结构域则负责ATP分子的水解以及双链DNA的解旋。不同于常规的SF3 Helicase家族蛋白,C962R蛋白为环状的12聚体,由两个6聚体head-to-head互作形成。DNA底物的入口处于6聚体的结合界面处,DNA非模版链的3’端可通过此入口进入C962R结构中心的孔道,利用SF3 Helicase结构域水解ATP、驱动蛋白质构象的变化以及DNA的解旋。尽管不参与直接的催化和解旋,C962R的PriCT2、D5_N以及Tail结构域参与DNA的结合,其构象变化对DNA解旋以及新生DNA的从头合成发挥了调控作用。C962R的DNA解旋和合成机制相对保守,但是在Tail等结构域的折叠方式上则与同源蛋白有明显的区别。
除了C962R蛋白外,ASFV的复制通路还包括了DNA聚合酶、拓扑异构酶、dUTPase以及PCNA等蛋白。PCNA在生物体中高度保守,尽管不具有催化功能,PCNA可以通过与其他蛋白互作,提高互作蛋白的催化效率,在DNA复制、修复以及其他DNA相关的通路中发挥了重要的调控作用。AsfvPCNA与同源蛋白的序列相似性非常低,其具体的结构和功能还没有得到充分的验证。为了全面了解ASFV DNA复制的过程,甘建华课题组同样对AsfvPCNA展开了研究,相关的结果于2023年8月3日发表在Journal of Viology杂志上,题为 “Structural and functional studies of PCNA from African swine fever virus”.

文章的研究结果显示AsfvPCNA蛋白由两个相似的结构域(Domain I和II)组成,其连接区域(IDCL)含有两个短的螺旋。与同源蛋白类似,AsfvPCNA主要以三聚体形式存在,其中心的孔道富含碱性氨基酸,可以像夹子一样卡在双链DNA上,并沿着DNA滑动。体外生化实验显示,AsfvPCNA具有很强的双链DNA结合能力,其独特的IDCL在AsfvLIG等互作蛋白的识别过程中发挥了作用,可以阻止互作蛋白从DNA上脱落,进而显著地提高其催化效率。

综上所述,尽管ASFV的DNA复制通路蛋白遵循经典的催化机制,这些蛋白可能含有一些独特的结构特征,为ASFV特异性的小分子抑制剂的开发及应用提供了基础。
课题研究受到国家自然科学基金面上项目的资助。复旦大学邵志伟博士为论文的第一作者,甘建华教授为论文的通讯作者。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad677
https://journals.asm.org/doi/10.1128/jvi.00748-23

